torsdag 14 april 2016
måndag 11 april 2016
tauriini ja pancreassaareke
http://www.ncbi.nlm.nih.gov/pubmed/19239166
Adv Exp Med Biol. 2009;643:353-8.
Taurine supplementation and pancreatic remodeling.
TAURIINI on semi-essentielli rikkiä sisältävä aminohappo, joka johtuu metioniini- ja cysteiinimetaboliasta. Tauriinilla on useita biologisia prosesseja, kuten hypoglykeminen vaikutus, antioksidaatio ja detoxikaatio. Tässä tutkimuksesa arvioitiin tauriinin osuus haimasaarekkeen kehittymisessä, koska endokriininen haima käy läpi merkitseviä modifikaatioita neonataalisen kehityksen aikana.
- Taurine is a semi-essential sulphur containing amino acid derived from methionine and cysteine metabolism. Taurine has several biological processes such as hypoglycemic action, antioxidation, and detoxification. In this study we evaluated the role of taurine in pancreatic islets development, since the endocrine pancreas undergoes significant modifications during neonatal life.
Hiirille syötettiin TAURIINIA ja niitä tutkittiin histologisesti. Niillä ei ollut mitään histologisia epänormaaliuksia niin endokriinisessä kuin exokriinisessä haimassakaan. Mutta TAURIINILISÄN anto juomavedessä johti drastisiin ja merkitseviin saarekeluvun lisääntymisiin leikkeissä. Edelleen saarekkeiden kokokin oli merkitsevästi suurempi. Tutkijat tekivät oletuksen, että endokriinisen haiman kehitykselle tärkeänTAURIININ lisä saattoi vähentää sytokiinien indusoimaa apoptoosia haiman betasoluissa. Endokriininen haima käy läpi merkitsevän modifioitumisen neonataalielämän aikana ja apoptoosi on tärkeä mekanimsi tässä " remodelling" uudelleen muovautumis- prosessissa. Tutkijat olettavat, että muovautumisprosessin muuntumiset voisivat vaikuttaa haitallisesti haiman Langerhansin saarekkeiden kehitykseen ja niillä voisi olla tärkeät vaikutukset haimasolumassaan ja endokriinisesn funktioon.
- Histological examination of the pancreas from taurine-fed mice revealed no histological abnormalities in the endocrine or exocrine parts of the pancreas. However, supplementation of taurine in the drinking water resulted in a drastic and significant increase in the number of islets per section. Furthermore, islets size was significantly larger. We hypothesize that supplementation of taurine, which is important for the development of the endocrine pancreas may reduce cytokine-induced apoptosis in pancreatic beta cells. The endocrine pancreas undergoes significant modifications during neonatal life and apoptosis is an important mechanism in this remodeling. We suggest that alteration of this remodeling process during this period of time, when a fine balance between cell replication and cell death is critical, would affect the development of the pancreatic islets of Langerhans, and could have important effects on the pancreatic cell mass and the endocrine function.
- PMID:
- 19239166
- [PubMed - indexed for MEDLINE]
- Kommentti: Tämä käsittääkseni tarkoittaa, että raskaanaolevien äitien proteiinin jo siinä metioniinin ja cystiinin saannin pitäisi olla riittävää. Niistä pitäisi tulla tauriinia kehossa. Tauriinia on myös joissain elintarvikkeissa.
lördag 9 april 2016
Somatostatiini on rikkipitoinen molekyyli, hermonvälittäjäaine
( Neurohormoni, jolla on dieetärisesti vaativa rakenne. 8 aminohappoa 14.sta on essentielliä ja lisäksi vielä 2 cysteiiniä. Näyttää olevan yhden genin tuote. Inhibitorinen vaikutus harmaan solukon hormonaalisiin erityksiin , myös GI-alueella vaikuttaa , vaimentaa insuliinieritystä.
:
Neuron. 2013 Jan 9;77(1):155-67. doi: 10.1016/j.neuron.2012.11.004.
Neocortical somatostatin-expressing GABAergic interneurons disinhibit the thalamorecipient layer 4.
Subtypes
of GABAergic interneurons (INs) are crucial for cortical function, yet
their specific roles are largely unknown. In contrast to supra- and
infragranular layers, where most somatostatin-expressing
(SOM) INs are layer 1-targeting Martinotti cells, the axons of SOM INs
in layer 4 of somatosensory cortex largely remain within layer 4.
Moreover, we found that whereas layers 2/3 SOM INs target mainly
pyramidal cells (PCs), layer 4 SOM INs target mainly fast-spiking (FS)
INs. Accordingly, optogenetic inhibition of SOM INs in an active
cortical network increases the firing of layers 2/3 PCs whereas it
decreases the firing of layer 4 principal neurons (PNs). This unexpected
effect of SOM INs on layer 4 PNs occurs via their inhibition of local
FS INs. These results reveal a disinhibitory microcircuit in the
thalamorecipient layer through interactions among subtypes of INs and
suggest that the SOM IN-mediated disinhibition represents an important
circuit mechanism for cortical information processing.
Copyright © 2013 Elsevier Inc. All rights reserved.
Copyright © 2013 Elsevier Inc. All rights reserved.
The hormone somatostatin has active 14 aa and 28 aa forms that are
produced by alternate cleavage of the single preproprotein encoded by
this gene. Somatostatin is expressed throughout the body and inhibits
the release of numerous secondary hormones by binding to high-affinity
G-protein-coupled somatostatin receptors. This hormone is an important
regulator of the endocrine system through its interactions with
pituitary growth hormone, thyroid stimulating hormone, and most hormones
of the gastrointestinal tract. Somatostatin also affects rates of
neurotransmission in the central nervous system and proliferation of
both normal and tumorigenic cells. [provided by RefSeq, Jul 2008]
Related articles in PubMed
- Promoter hypermethylation-related reduced somatostatin production promotes uncontrolled cell proliferation in colorectal cancer. Leiszter K, et al. PLoS One, 2015. PMID 25723531, Free PMC Article
- The clinical significance of somatostatin in pancreatic diseases. Sliwińska-Mossoń M, et al. Ann Endocrinol (Paris), 2014 Sep. PMID 25156131
- Lack of difference among terlipressin, somatostatin, and octreotide in the control of acute gastroesophageal variceal hemorrhage. Seo YS, et al. Hepatology, 2014 Sep. PMID 24415445
- Neocortical somatostatin-expressing GABAergic interneurons disinhibit the thalamorecipient layer 4. Xu H, et al. Neuron, 2013 Jan 9. PMID 23312523, Free PMC Article
- Unique functional properties of somatostatin-expressing GABAergic neurons in mouse barrel cortex. Gentet LJ, et al. Nat Neurosci, 2012 Feb 26. PMID 22366760
GeneRIFs: Gene References Into FunctionsWhat's a GeneRIF?
- In cancerous colonic mucosa promoter hypermethylation-related SST downregulation may contribute to the uncontrolled cell proliferation.
- Aberrant methylation inactivates somatostatin and SSTR1 in head and neck squamous cell carcinoma.
- Distribution of peptidergic populations in the human dentate gyrus (somatostatin [SOM-28, SOM-12] and neuropeptide Y [NPY]) during postnatal development.
- The aim of the study was to provide knowledge on somatostatin and its action on the body, particularly the pancreas - in physiological and pathological conditions--{REVIEW}
- Somatostatin and insulin together are critical paracrine mediators of glucose-inhibited glucagon secretion and function by lowering cAMP/PKA signaling with increasing glucose.
- No somatostatin promoter hypermethylation was detected in the Alzheimer neocortex.
- Hemostatic effects and safety does not differ significantly between somatostatin and octreotide as adjuvants to endoscopic treatment in patients with acute gastroesophageal variceal bleeding.
- Somatostatin neurons contribute differently to spatial integration.
- somatostatin limits VEGF release through its interaction with miR-361, indicating that miR-361 participates in the adaptive response of human umbilical vein endothelial cells to hypoxia
- Somatostatin interneurons-mediated disinhibition represents an important circuit mechanism for cortical information processing.

RIKKIAINEENVAIHDUNTA. Metioniini ja cysteiini , rikkipitoiset aminohapot (2007)
RIKKIAINEENVAIHDUNTA
(suomennosta)
HUOM:
tämä artikkeli ei käsittele rikkiaineenvaihdunnan tauriini-tietä.
Tauriini on luonnollisesti normaalipitoisuudessa jos koko tämä
rikkiaineenvaihdunta toimii ja se on näkymätön vitaali
normaliteetti, jota yleensä ei mitenkään katsota
laboratoriokokeissa.
Tämä
rikin käsittely lähinnä kohdistaa huomiota mm.
nivelten kuntoon. Tauriini taas hoitaa solutason tilavuuksia.( Tanskal. Lambert)
Saammeko ravinnostamme tarpeeksi rikkiä?
-
(1) Tiivistelmän suomennosta
Marcel E NimniEmail author,
Bo Han and Fabiola Cordoba Nutrition &
Metabolism20074:24 DOI: 10.1186/1743-7075-4-24 ©
Nimni et al; licensee BioMed Central Ltd. 2007 Received:
08 May 2007 Accepted: 06 November 2007
Published: 06 November 2007
RIKKI, sulfur, on kalsiumin ja
fosforin jälkeen kaikkein runsain mineraalialkuaine, jota kehosta
löytyy. Rikki on meille saatavilla olevassa muodossa meidän
ravinnossamme ja sitä tulee miltei yksinomaan proteiinista ja vain
kahdesta aminohaposta jotka kuuluvat niihin kahteenkymmeneen
kehorakenteemm proteiinien aminohappojen kirjoon
-
Kehomme 20 rakenneaminohappoa ovat.
-
glysiini, alaniini,
-
valiini, leusiini, isoleusiini,
-
seriini, treoniini,
-
cysteiini, metioniini,
-
aspartaatti, asparagiini, glutamiinihappo, glutamiini,
-
arginiini, lysiini, histidiini
-
proliini (hydroxyproliini)
-
fenylalaniini, tyrosiini, tryptofaani
Näistä vain kaksi aminohappoa tuo
kehoon orgaanista rikkiä: Cysteiini ja metioniini. Keho ei pysty
tekemään emtioniinia ja sen takia sitä pitä tulla ravinnossa. Se
on essentielli aminohappo. Sensijaan cysteiiniä voi kehon
aineenvaihdunnassa muodostua tästä metioniinista käsin. Monia
elämälle välttämättömiä avainaseamssa olevaia
aineenvaihdunnallisia tuoteita voi kehossa muodostua, mutta prosessi
vaatii jatkuvaa rikin saantia .
Valkuaisaineen rikkiä sisältävien
aminohappojen pitoisuus on 3% - 6%. Hyvin pieni osa kehon rikistä
tulee epäorgaanisista sulfaateista ja muista orgaanisen rikin
muodoista, mitä elintarvikkeissa esiintyy kuten kynsilaukassa,
sipulissa, parsakaalissa ym.
Essentiellien
aminohappojen alin tarve (RDA) on aina tavattu arvioida
typpitasapainon ylläpitämisen kannalta Tämä metodi määrittelee
aminohappojen tarpeet proteiinisynteedin vaatimuksien mukaan, mikä
taas on ravinnossa saatavan metioniinin kannalta vain yksi
aineenvaihdunnallinen reitti sen monista reiteistä. Jota voisi
asianmukaisesti arvioida metioniinin vähimmän tarpeen, pitäisi
typpitasapainon ohella myös pitää yllä rikkitasapainoa – mitä
ei koskaan lie suoritettu ihmisellä eikä eläimillä.
Tästä näkökulmasta
tutkijaryhmä arvioi rikin saannin ravinnosta ( rikkiä
sisältävinä aminohappoina) summittaisesti valitusta väestöstä
ja suoritti rikkitasapainotutkimuksia rajoitetulta
vapaaehtoisten joukolta. Aluksi tätä tehtiin yrittäen saada jotain
informaatiota mahdollisesta rikkiä sisältävien yhdisteiden
vaikutustavasta - näitä yhdisteitä olivat kondroitiinisulfaatti,
glukosamioisulfaatti ym joita käytetään ravintolisinä
niveltautien hoidossa. Tästä tutkimuksesta saatiin tieto, joka
viittasi merkitsevän väestöosan (ikääntyneitä joukossa
epäsuhtaisesti) saavan mahdollisesti riittämättömästi rikkiä
ravinnossaan. Saatiin myös tieto, että nämä ravintolisät hyvin
todennäköisesti ilmensivät farmakologisia vaikutuksiaan
toimittamalla epäorgaanista rikkiä.Johdannon suomennosta.
(2) Johdanto
Tutkijat päättivät syventää katsaustaan
käsittämään laajemmin toisiaan kattavia aineenvaihdunnallisia
teitä, jotka voisivat kärsiä riittämättömästä tai niukasta
rikin saannista , sillä rikkiaineenvaihdunta on laajempisisältöinen
kuin vain epäorgaanisen sulfaattin tie, ja rikki vaikuttaa monien
avainasemassa olevien aineenvaihdunnallisten välituotteiden, esim.
glutationin (GSH) synteesissä. Toivotaan, että aktsaus
virittää jatkotutkimuksia jotka kohdistuvat tähän hyvin tärkeään,
mutta usein hoitamatta jätettyyn, laiminlyötyyn aineenvaihdunnan
alueeseen.
Rikkiä sisältäviä yhdisteitä, glutationi
(GSH) avainasemassa, liittyy toiminnassaan moniin muihin
yhdisteihin, joilla on suurta tehtävää hyvin kiintoisissa
mekanismeissa perinteisen ja täydentävän lääketieteellisen
hoidon osana. Näihin kuuluu omega3- ja omega6- monityydyttämättömät
rasvahapot, mineraalit kuten seleeni, sinkki, kupari ja magnesium, E
ja C vitamiinit, antioksidantit proantosyanidiinit ja liponihappo,
joista monet osallistuvat prostaglandiinien synteesiin ja
antioksidatiiviseen kaskadiin. Yhä runsaampaa näyttöä kertyy
glutationin (GSH) ja muiden rikkiaineenvaihduntatuotteiden
ko-operoivasta osuudesta näiden fundamentaalisten mekanismien
homeostaattisessa kontrollissa.
(3) Rikkiä sisältävien aminohappojen aineenvaihdunta.
Sekä yksimahaiset imettäväiset että linnut
vaativat proteiinisyntesiinsä metioniinia ja cysteiiniä. Dieetissä
täytyy olla näitä molempia metioniini ja kysteiiniä tai
yksin metioniinia, jotta kasvu olisi normaalia. Cysteiinin
fysiologisen tarpeen kattaa cysteiini tai dietäärinen
metioniinilisä. Trans-sulfuraation molaarinen tehokkuus, siis
metioniini-rikin muuttuminen cysteiini-rikiksi on 100%. Cysteiini voi
alentaa ravinnossa tarvittavan metioniinin tarpeita, vaikka yhtään
cysteiiniä ei muutu metioniiniksi korkeimmissa organismeissa –
säästämällä sen hyödyntämistä essentielleihin prosesseihin.
Dieettinäkökohdasta metioniini yksinään kykenee antamaan
kaiken kehorikin, poikkeuksena on kaksi rikkipitoista vitamiinia,
joita pitää saada ravinnossa. Nämä ovat tiamiini ja
biotiini.
Vuonna
1989 US-FNB,
NRC päivitti proteiinin ja aminohappojen ravintosusitukset (RDA).
Nämä perustuivat typpitasaapinotutkimuksiin useita vuosia
aikaisemmin. RDA aikuisten metioniinille ( metioniini + cysteiini)
asetettiin 14 milligrammaan painokiloa kohden päivässä. Sen takia
70 kiloa painavalle henkilölle iästä ja sukupuolesta riippumatta
tarvitaan päivän ravinnossa 1.1 grammaa (0.9 mMol) metioniinia (
metioniini+ cysteiini). Rosen ehdotus näistä määristä
turvallinen saanti huomioon ottaen oli kaksinkertainen, 2.0 grammaa
päivässä . Mahdollsesti tähän suositukseen johti se että
tutkimuksiin oli osallistunut rajoitettu määrä yksilöitä,
tavallisesti 3- 6 henkilöä yhden aminohapon selvittelyyn.
Nämä
ihmisen
metioniinitarpeet ja
cysteiinin
säästävä vaikutus
-
määritettynä nuorilta vapaaehtoisilta 1955
Rose
et al. - työryhmän mukaan - pidetään vielä nykyään voimassa
huolimatta viitteistä, että ne mahdollisesti eivät edustakaan
universaalisia arvoja. Nämä vapaehtoiset olivat nuoria
korkeakouluopiskelijoita. Tuttle et al. tekivät kokeensa vanhemmilla
yksilöillä VA Hospital-sairaalassa Los Angelesin UCLA yliopistossa
ja hän antoi puhdistettuja aminohappoja sisältävää dieettiä,
jossa metioniinimäärät olivat vaihtelevia ja he päätyivät
merkitsevästi suurempiin arvoihin kuin Rose et al. Kaikki kokeeseen
osallistuneet tarvitsivat yli 2.1 g metioniinia päivässä, jotkut
jopa 3.0 g metioniinia, jotta typpitasapaino olisi pysynyt
positiivisena.
Vaikka Fukagawa et al. eivät pystyneetkään
vahvistamaan sellaisia eroja käyttämällä aminohappo-oksidaatiota
pikemminkin kuin typpitasapainoa kriteerinä, he olivat kuitenkin
sitä mieltä, että jatkotutkimuksia tarvittaisiin. Ei heidän
tapansa lähestyä asiaa perustamalla isotoopilla rikastuneen
hiilihdioksidin tuotantoon eikä myöskään typpitasapainoon
perustuvat tutkimukset ottaneet huomioon rikkipitoisten aminohappojen
ainutlaatuista osuutta sulfaatiorikin tuotossa. Fuller
et Garlick tekivät katsauksen aiheesta yksityiskohtia myöten ja
tulivat siihen johtopäätökseen, että sekä miesten että naisten
aminohappotarpeet
näyttävät aliarvioiduilta.
Näin
ollen näyttää välttämättömältä määritellä, onko
rikintarpeet todellakin katetut, pitäähän
rikkipitoisten aminohappojen (SAA) tuoda sulfaattia
glukosaminoglykaanien (GAG) synteesiin ja erityisesti näitä GAG ja
GSH esiintyy rustossa.
Voi
vain arvata, että GAG-synteesi ei liene hyvänlainen, jos
metioniinin saanti on niukkaa, marginaalista ja arveltavasti keho
priorisoi proteiinien
synteesiä
ja aineenvaihdunnan essentiellejä välituotteita : CoA, SAM
(S-adenosyyli-L-metioniini), GSH jne. aivoissa ja muissa
fundamentaaleissa elimissä. Niin vain on, että tästä tärkeästä
pohdinta-aiheesta ei ole suoritettu tutkimuksia.
Ihmiskokeitten suoritus ei ole helppoa, ne ovat ekonomisesti vaativia
ja monen variabelin vaikuttamia. Muilta lajeilta saa enemmän
infomaatiota, erityisesti siipikarjalta ja muulta karjalta, missä
kasvustimuluksella on huomattava ekonominen hyötynsä- Tässä
huomautetaan, että siipikarjan rehuun lisätään aina
metioniinia/cysteiiniä kasvun edistämiseksi.
4. Tekijät, jotka voivat vähentää metioniinin ja cysteiinin saatavuutta.
SULFAATIO,
sulfuroiminen, on päätie maksan suorittamassa farmakologisten
aineitten myrkyttömäksi tekemisessä eli detoksikaatiossa Tietyt
lääkeet, joilla on ruston poikkeavuuksissa hoidollista avainosaa
(kuten asetaminofen) vaativat erittymiseensä sulfaattia.
Asetaminofeniä on annettu aiemmin suurissa annoksissa kivun
lievitykseen ja annoksissa mainitaan 4 grammaakin päivässä, jopa
vielä enemmän joku käyttää. Tästä 35% erittyy sulfaattiin
konjugoituneena ja 3 % cysteiiniin konjugoituneena. Loput erittyvät
glukuronihappoon konjugoituneena, glukuronihappo on -ohimennen
sanoen- GAG:ssa pääkomponentteja. (Huom Ruotsin asenne tähän
lääkkeeseen: parasetamol
http://www.lakartidningen.se/Functions/OldArticleView.aspx?articleId=11467)
Ravintoon lisätty metioniini tai cysteiinim ( 0.5%) voi voittaa
vaikean metioniinivajeen, joka koe-eläimissä on aiheutettu
lisäämällä 1% acetaminofeniä ( parasetamolia) ( Ihmisellä tuo
koe-eläinannos vastaisi 4 grammaa parasetamolia päivässä)-
Mielenkiintoista on huomata, että sekä D-metioniini
että
L-metioniini
pystyy
palauttamaan kasvun, jos primäärivaje oli rikistä eikä
proteiinisynteesistä johtuvaa. Mitä tärkeintä on, että maksan
”aktiivin
sulfaatin” pitoisuus PAPS-muotoisena
( adenosiini-3´-fosfaatti-5´-fosfosulfaatti) on avainaseman
aineenvaihdunnallinen edeltäjäaine glykosaminoglykaanille
(GAG)
ja sekin oli vähentynyt ja sen pitoisuus saatettiin kohottaa
normaaliksi lisämetioniinia antamalla. Virtsan sulfaatin eritys oli
alentunut jopa 95%, jos annettiin koe-eläimille metioniiniköyhää
dieettiä ja samalla havaittiin että maksan metioniini laski 60%.
Metioniinilisällä - riippuen vajeen korjaamisen asteesta - saatiin
aikaan normaalia sulfaatin erittymistä ja maksan GSH-pitoisuutta.
Epäorgaaninen sulfaatti ei ollut yhtä tehokas PAPS-pitoisuuksien
kohottaja kuin metioniini ( orgaanista rikkiä antava aminohappo)(
Kommenttini: tässä on myös muistettava että transsulfuraation
apuna
PAPS -molekyyliä eli ”aktiivia sulfaattia” muodostettaessa
toimii K-vitamiini koentsyyminä
ja B6-vitamiini säätelee negatiivisesti entsyymiä. Myös arylsulfataasien koentsyymi on K-vitamiini).
Linkin yksinkertaistetusta kuvasta Fig.1 näkee,
mikä suhde vallitsee rikkipitoisten aminohappojen (SAA),
glykosaminoglykaanien ( GAG) synteesin, Glutationin (GSH) (cysteiinin
varastoitumismuodon) , proteiinisynteesin ja typpiaineenvaihunnan
kesken.
On tutkittu rikkiä liian vähän saaneita jyrsijöitä ja niissä tapahtuvaa parasetamolin (asetaminofen) detoksikoitumista eli sulfaatiota. Tarkoituksena oli, että katsottiin, minkälainen biologisen hajoamisen muuntuminen tapahtuu ”aktiivin sulfaatin” PAPS homeostaasissa, kun rikistä on vaje. Nämä eläimet eliminoivat asetaminofeniä verestään hitaammin ja se muuttui myrkylliseksi tioeetterivälituotteeksi. Alentuneen sulfaation katsottiin johtuneen epäorgaanisen fosfaatin alentuneesta saatavuudesta PAPS-synteesiin.
(Artikkelissa on yhteensä 12 kappaletta.) Alkua suomennettu 9.4. 2016
https://nutritionandmetabolism.biomedcentral.com/articles/10.1186/1743-7075-4-24
Tästä artikkelista otan joitain sitaatteja suomennettavaksi. Abastraktin ja
lopusta Discussion- osa:
On tutkittu rikkiä liian vähän saaneita jyrsijöitä ja niissä tapahtuvaa parasetamolin (asetaminofen) detoksikoitumista eli sulfaatiota. Tarkoituksena oli, että katsottiin, minkälainen biologisen hajoamisen muuntuminen tapahtuu ”aktiivin sulfaatin” PAPS homeostaasissa, kun rikistä on vaje. Nämä eläimet eliminoivat asetaminofeniä verestään hitaammin ja se muuttui myrkylliseksi tioeetterivälituotteeksi. Alentuneen sulfaation katsottiin johtuneen epäorgaanisen fosfaatin alentuneesta saatavuudesta PAPS-synteesiin.
(Artikkelissa on yhteensä 12 kappaletta.) Alkua suomennettu 9.4. 2016
https://nutritionandmetabolism.biomedcentral.com/articles/10.1186/1743-7075-4-24
Tästä artikkelista otan joitain sitaatteja suomennettavaksi. Abastraktin ja
lopusta Discussion- osa:
Abstract
Sulfur,
after calcium and phosphorus, is the most abundant mineral element
found in our body. It is available to us in our diets, derived almost
exclusively from proteins, and yet only 2 of the 20 amino acids normally
present in proteins contains sulfur. One of these amino acids,
methionine, cannot be synthesized by our bodies and therefore has to be
supplied by the diet. Cysteine, another sulfur containing amino acid,
and a large number of key metabolic intermediates essential for life,
are synthesized by us, but the process requires a steady supply of
sulfur.
Proteins
contain between 3 and 6% of sulfur amino acids. A very small percentage
of sulfur comes in the form of inorganic sulfates and other forms of
organic sulfur present in foods such as garlic, onion, broccoli, etc.
The
minimal requirements (RDA) for all the essential amino acids have
always been estimated in terms of their ability to maintain a nitrogen
balance. This method asses amino acid requirements for protein
synthesis, only one of the pathways that methionine follows after
ingestion. To adequately evaluate the RDA for methionine, one should
perform, together with a nitrogen balance a sulfur balance, something
never done, neither in humans nor animals.
With
this in mind we decided to evaluate the dietary intake of sulfur (as
sulfur amino acids) in a random population and perform sulfur balance
studies in a limited number of human volunteers. Initially this was done
to try and gain some information on the possible mode of action of a
variety of sulfur containing compounds (chondroitin sulfate, glucosamine
sulfate, and others, ) used as dietary supplements to treat diseases of
the joints. Out of this study came information that suggested that a
significant proportion of the population that included disproportionally
the aged, may not be receiving sufficient sulfur and that these dietary
supplements, were very likely exhibiting their pharmacological actions
by supplying inorganic sulfur.
Discussion
Glutathione
(GSH) is the most abundant low molecular weight thiol and form of
storage of SH-.
Animal and human studies have demonstrated that adequate
protein nutrition is crucial for the maintenance of GSH homeostasis [48].
Elevated levels of GSH inhibit prostaglandin production by a direct
interaction with COX enzymes, of potential significance in the
progression of inflammatory or degenerative states [36].
It is of particular interest, as discussed earlier that prostagandins
synthesized from PUFA and most of the non-steroidal anti-inflammatory
drugs (NSAID) share this same locus of involvement.
It is also relevant that
some recent studies have found that on occasions the pain reduction in
OA associated with the administration of chondroitin sulfate, a source
of sulfur, was found to be equivalent to that provided by NSAID. The
reasons for such unpredictable results, we suspect could be associated
with differences in levels of protein in the diet, the better responders
consuming higher amounts of SAA. This hypothesis will have to be
evaluated in future clinical studies.
As
discussed neither cysteine nor methionine are stored in the body. Any
dietary excess is readily oxidized to sulfate, excreted in the urine (or
reabsorbed depending on dietary levels) or stored in the form of
glutathione (GSH). Even in extreme situations, such as when tryptophane
deficiency leads to a general catabolic effect, the organism tries to
spare the loss of sulfur by continuing to store any available sulfur as
GSH in the liver. GSH values are subnormal in a large number of wasting
diseases and following certain medications, and by supplying SAA many of
these changes can be reversed [49].
Whether dietary supplements containing sulfur display similar effects
has not been evaluated systematically. Documented improvements in OA and
joint pains associated with sulfurated water hydrotherapy, many times
accompanied by the simultaneous ingestion of such waters has also been
related to the GSH involvement in the antioxidant cascade.
In
spite of the apparent complexity associated with evaluating the dietary
intake of a population as a whole a pattern seems to emerge, even when
evaluating small groups of individuals. In milk and dairy products the
methionine/cysteine ratio is around 3/1. It is roughly the same in
fishes such as canned tuna, which we used as a source of protein
supplement in our studies, and in meats.
In eggs, soy beans and other
plant products it is around 4/3. The amount of protein in the various
foods varies considerably, and the amount of SAA fluctuates. Chicken,
fish and beef proteins contain an average of around 5% of SAA. Dairy
products, milk, cheese, etc, contain lower levels, around 4%, primarily
due to the lower content of SAA in casein. The whey protein fraction,
accounts for about 20% of the milk proteins (rich in lactoglobulins)
contains more SAA, and is used therapeutically or as a dietary
supplement. Plant proteins, in addition to be present in lower amounts,
are relatively low in SAA, averaging below 4%. The highest content of
SAA is found in egg products, the egg white containing around 8% of SAA.
Consequently
the ratios observed in a dietary survey will reflect the amounts of
meats, eggs and plant products consumed. The amounts of protein, as a %
of the calories consumed, is a major variable in the population. The
more weight conscious individuals, and often the ones in more affluent
societies, tend to consume less carbohydrate and fats and more proteins.
This is counterbalanced some times by the tendency of many to consume
less animal products and therefore to include more carbohydrates. In
addition the desire to lose weight may reduce both calories and protein
intake. Older people, at a time when OA becomes more prevalent, decrease
their food intake often at the expense of proteins, frequently due to
economic concerns.
Most
individuals fall in between the groups established arbitrarily for the
purpose of this study, but once a dietary pattern is established
deviations are much less than expected. In our experimental studies, the
levels of SAA were predetermined and individuals placed on pre-assigned
diets containing known amounts of protein. This is critical, since even
though the amounts of SAA intake closely reflects the rate of sulfate
excretion, below a certain level of intake tubular reabsorption of
sulfates prevents further loss. In rats, sulfate renal clearance was
significantly decreased in animals that received a low methionine diet, a
reflection of a sparing mechanism to retain sulfate [39].
A major unanswered question is how the overall caloric intake affects
the requirements of sulfur used for other than protein synthetic
purposes, and how long a sparing effect can continue during the
prolonged intake of a low protein diet.
Any
excess of SAA is oxidized to inorganic sulfate and excrete in the urine
as neither organic nor inorganic excesses of sulfur can be stored. The
normal concentration of sulfate in serum is around 3.5 mg/100 ml,
roughly 5–10% of that as ether sulfate and the rest as sulfate ions.
Sulfur is excreted in the urine as it exists in blood.
A
deficiency of sulfur amino acids has been shown to compromise
glutathione synthesis to a greater extent than protein synthesis in the
presence and absence of inflammatory stimulus [34].
During an immune/inflammatory response a combination of enhanced
utilization of cysteine for GSH synthesis and cell replication may be
what leads to a depletion of cellular SAM.
In
man serum fasting levels of inorganic sulfate were shown to increase
with age and exhibit a circadian rhythm, probably associated with food
intake. Genetic defects in sulfate transport have been associated with
congenital osteochondrodystrophies that may be lethal and provide
insights into sulfate transport and hormonal and nutritional regulation [50].
Whereas low levels of dietary protein led to hip joint displasia in
mice and rats normal levels inhibited the development of OA.
Even
though under normal circumstances dietary inorganic sulfate contributes
very little to our sulfate pool, the exogenous administration of small
amounts of sulfate in selected forms of delivery may be useful, since
contrary to what is still a common belief sulfate can be absorbed form
the GI tract [41, 51].
Along these lines the possible beneficial effects of inorganic sulfates
in drinking water should be evaluated. Certain sulfur containing
thermal water baths have been found to be of benefit, probably via
transdermal penetration or because of actual drinking of such waters at
health spas [21, 52–55].
On
the other hand it is important to recollect that sulfation is a major
pathway for detoxification of pharmacological agents by the liver. Drugs
such as acetaminophen, so frequently used in the treatment of pain
associated with joint diseases, require large amounts of sulfate for
their excretion. Doses of up to 4 g/day are not infrequent. Thirty five %
is excreted conjugated with sulfate, 3% conjugated with cysteine [12]
and the rest conjugated with glucuronic acid, incidentally a major
component of glycosamino glycans (GAG) which are so critical for the
integrity of cartilage and other connective tissues.
Methionine
or cysteine (0.5%) added to the diet can overcome the severe methionine
deficiency induced in rats by the addition of 1% acetaminophen, an
equivalent to the 4 g/day of the human dose. D- as well as L-methionine
were found to be equally effective, suggesting that depletion of sulfur
was at the root of the primary defect and that it was unrelated to
protein synthesis. It is well known that N-acetyl-p-benzoquinoneimine, a
toxic metabolite of acetaminophen is detoxified by hepatic GSH. Rapid
administration of acetyl-cysteine to restore GSH levels remains the
treatment of choice following acetaminophen poisoning. Hepatic
concentrations of active sulfate, in the form of PAPS
(adenosine-3'-phosphate 5'-phosphosulfate) were also decreased and could
be restored to normal by supplementation with methionine [13].
The
effectiveness of D-methionine in this connection brings back to mind
the early studies of Rose who used DL-methionine in his early balance
studies which led to the RDA recommendations, again suggesting a
significant role for the SAA, beyond that of protein synthesis. That
cysteine, sulfite and other sources of sulfates can serve as precursors
for GAG synthesis has been well established [56–58].
Also restricting the availability of dietary sulfur in rats (cysteine,
sulfate) decreased the biotransformation of acetaminophen, as a
consequence of the absence of inorganic sulfate for PAPS synthesis [13, 15].
Consequently, addition of a sulfur containing compound to medications
such as acetaminophen or catabolic agents such as the corticosteroids,
may be a potential way to compensate for sulfur loss.
A
major question that arises in connection with dietary supplements that
provide organic forms of sulfur, is whether the diet could account for
differences in response amongst individuals. It is possible that the
individuals that benefit mostly from these supplements are those that
consume inadequate amounts of protein or other sources of dietary
sulfate. A recent publication by Drogue [59, 60],
who has extensively investigated the relationship of oxidative stress
and aging, has concluded that this event may be in great part be
associated with a deficit of cysteine and to a suboptimal intake of SAA.
Finally
it may be relevant to conclude this review with a statement taken from
Sir Stanley Davidson and Passmore's classic textbook of Human Nutrition
and Dietetics [61]
who suggested that" it is not unlikely that some of the effects of
protein deficiency are in fact due to failure of sulfur containing
intermediates or even to sulfur containing polysaccharides. It is even
possible that the ancient nostrum of 'brimstone and treacle' (sulfur and molasses) had nutritional value unsuspected by modern knowledge".
Etiketter:
metioniini ja cysteiini,
Rikkiaineenvaihdunta
Tauriinilisän merkitys glukoosin homeostaasissa
15.
Santos-Silva JC,
Ribeiro RA, Vettorazzi JF, Irles E, Rickli S, Borck PC, Porciuncula PM,
Quesada I, Nadal A, Boschero AC, Carneiro EM.
Amino Acids. 2015 Aug;47(8):1533-48. doi: 10.1007/s00726-015-1988-z. Epub 2015 May 5.
Taurine (Tau) regulates β-cell function and glucose homeostasis under
normal and diabetic conditions. Here, we assessed the effects of Tau
supplementation upon glucose homeostasis and the morphophysiology of
endocrine pancreas, in leptin-deficient obese (ob) mice. From weaning
until 90-day-old, C57Bl/6 and ob mice received, or not, 5% Tau in
drinking water (C, CT, ob and obT). Obese mice were hyperglycemic,
glucose intolerant, insulin resistant, and exhibited higher hepatic
glucose output. Tau supplementation did not prevent obesity, but
ameliorated (paransi) glucose homeostasis in obT. Islets from ob mice presented a
higher glucose-induced intracellular Ca(2+) influx, NAD(P)H production
and insulin release. Furthermore, α-cells from ob islets displayed a
higher oscillatory Ca(2+) profile at low glucose concentrations, in
association with glucagon hypersecretion. In Tau-supplemented ob mice,
insulin and glucagon secretion was attenuated, while Ca(2+) influx
tended to be normalized in β-cells and Ca(2+) oscillations were
increased in α-cells. Tau normalized the inhibitory action of somatostatin
(SST) upon insulin release in the obT group. In these islets,
expression of the glucagon, GLUT-2 and TRPM5 genes was also restored.
Tau also enhanced MafA, Ngn3 and NeuroD mRNA levels in obT islets.
Morphometric analysis demonstrated that the hypertrophy of ob islets
tends to be normalized by Tau with reductions in islet and β-cell
masses, but enhanced δ-cell mass in obT. Our results indicate that Tau
improves glucose homeostasis, regulating β-, α-, and δ-cell
morphophysiology in ob mice, indicating that Tau may be a potential
therapeutic tool for the preservation of endocrine pancreatic function
in obesity
Similar articles
Oma kommentti:
Koska tauriini on kehon rikkiaineenvaihdunnan kärhimolekyyli, ja sen rakentuminen kehossa on riippuvainen essentielleistä aminohapoista, joissa on orgaanista rikkiä ( metioniini + cysteiini) , näiden ravinnosta saatavien aminohappojen metabolisten teiden tulee toimia: B12, vitamiini, foolihappo avustavat että ei kerry plasman homocysteiiniä, vaan tie tauriiniin ja aktiivin sulfaattiin pysyy kunnossa. tässä on vielä muillakin b-vitamiineillakin merkitystä sekä rikkiaineenvaihduntaan vaikuttavalla K- vitamiinilla
Jos ihmisen tulee saada suoranaista tauriinia ravinnossa ( kuten kissan9, ei kai ole aivan lukkoonlyöty asia.
Joka tapauksessa pHcy ei saisi kertyä.
Ylläolevassa artikkelissa käsitellään tauriinin antoa obesitaksessa. obesitas on taas tila, jossa kehosas on paljon sellaista lipidiä, jonka hyödyntämiseen tarvitaisiin b12-vitamiinin funktiota, propionihappomuotojen oksidoiminen. B12- saatavuus fundamentaalisessa CSC.ssa voi olla kyseenalaista, joten toksisuuden välttämiseski neutraalirasvan siirtäminen lihavuutena varastotiloihin on toksisuuden välttämistä. Silloin on tietysti hydyksi saada tauriinia valmiina- kun muiden terapioiden avulla normalisoidaan ylipainotilaa, esim liikunnalla ja kalorirajoituksella ja kovan rasvan vähentämisellä.
9.4. 2016
Oma kommentti:
Koska tauriini on kehon rikkiaineenvaihdunnan kärhimolekyyli, ja sen rakentuminen kehossa on riippuvainen essentielleistä aminohapoista, joissa on orgaanista rikkiä ( metioniini + cysteiini) , näiden ravinnosta saatavien aminohappojen metabolisten teiden tulee toimia: B12, vitamiini, foolihappo avustavat että ei kerry plasman homocysteiiniä, vaan tie tauriiniin ja aktiivin sulfaattiin pysyy kunnossa. tässä on vielä muillakin b-vitamiineillakin merkitystä sekä rikkiaineenvaihduntaan vaikuttavalla K- vitamiinilla
Jos ihmisen tulee saada suoranaista tauriinia ravinnossa ( kuten kissan9, ei kai ole aivan lukkoonlyöty asia.
Joka tapauksessa pHcy ei saisi kertyä.
Ylläolevassa artikkelissa käsitellään tauriinin antoa obesitaksessa. obesitas on taas tila, jossa kehosas on paljon sellaista lipidiä, jonka hyödyntämiseen tarvitaisiin b12-vitamiinin funktiota, propionihappomuotojen oksidoiminen. B12- saatavuus fundamentaalisessa CSC.ssa voi olla kyseenalaista, joten toksisuuden välttämiseski neutraalirasvan siirtäminen lihavuutena varastotiloihin on toksisuuden välttämistä. Silloin on tietysti hydyksi saada tauriinia valmiina- kun muiden terapioiden avulla normalisoidaan ylipainotilaa, esim liikunnalla ja kalorirajoituksella ja kovan rasvan vähentämisellä.
9.4. 2016
Etiketter:
tgauriinilisä glukoosin hoomeostaasissa.
tisdag 5 april 2016
Keratiini ja munuainen
http://www.kidney-international.org/article/S0085-2538%2815%2900171-4/fulltext#sec1.5
http://www.ncbi.nlm.nih.gov/pmc/articles/PMC2386534/
http://www.ncbi.nlm.nih.gov/pmc/articles/PMC2386534/
söndag 13 mars 2016
Liponihaponsyntaasin geeni LIAS
http://www.ncbi.nlm.nih.gov/gene/11019
- Official Symbol
- LIASprovided by HGNC
- Official Full Name
- lipoic acid synthetaseprovided by HGNC
- Primary source
- HGNC:HGNC:16429
- See related
- Ensembl:ENSG00000121897; HPRD:09514; MIM:607031; Vega:OTTHUMG00000099369
- Gene type
- protein coding
- RefSeq status
- REVIEWED
- Organism
- Homo sapiens
- Lineage
- Eukaryota; Metazoa; Chordata; Craniata; Vertebrata; Euteleostomi; Mammalia; Eutheria; Euarchontoglires; Primates; Haplorrhini; Catarrhini; Hominidae; Homo
- Also known as
- LS; LAS; LIP1; PDHLD; HUSSY-01
- Summary
- The protein encoded by this gene belongs to the biotin and lipoic acid synthetases family. It localizes in mitochondrion and plays an important role in alpha-(+)-lipoic acid synthesis. It may also function in the sulfur insertion chemistry in lipoate biosynthesis. Alternative splicing occurs at this locus and two transcript variants encoding distinct isoforms have been identified. [provided by RefSeq, Jul 2008]
- Orthologs
- mouse all
Related articles in PubMed
- Lipoic acid synthetase deficiency causes neonatal-onset epilepsy, defective mitochondrial energy metabolism, and glycine elevation. Mayr JA, et al. Am J Hum Genet, 2011 Dec 9. PMID 22152680, Free PMC Article
- Variant non ketotic hyperglycinemia is caused by mutations in LIAS, BOLA3 and the novel gene GLRX5. Baker PR 2nd, et al. Brain, 2014 Feb. PMID 24334290, Free PMC Article
- Lipoic acid synthase (LASY): a novel role in inflammation, mitochondrial function, and insulin resistance. Padmalayam I, et al. Diabetes, 2009 Mar. PMID 19074983, Free PMC Article
- Do mammalian cells synthesize lipoic acid? Identification of a mouse cDNA encoding a lipoic acid synthase located in mitochondria. Morikawa T, et al. FEBS Lett, 2001 Jun 1. PMID 11389890
- Characterization of 16 novel human genes showing high similarity to yeast sequences. Stanchi F, et al. Yeast, 2001 Jan 15. PMID 11124703
GeneRIFs: Gene References Into FunctionsWhat's a GeneRIF?
- Patients with LIAS nonketotic hyperglycinemia varied in disease severity and cortical involvement.
- We identified the homozygous mutation c.746G>A (p.Arg249His) in LIAS in an individual with neonatal-onset epilepsy, muscular hypotonia, lactic acidosis, and elevated glycine concentration in plasma and urine
- Observational study of gene-disease association. (HuGE Navigator)
- Lipoic acid synthetase deficiency results in an overall disturbance in the antioxidant defense network, leading to increased inflammation, insulin resistance, and mitochondrial dysfunction.
Submit: New GeneRIF CorrectionAssociated conditions
Pyruvate dehydrogenase lipoic acid synthetase deficiency is an autosomal recessive disorder of mitochondrial metabolism characterized by early-onset lactic acidosis, severe encephalomyopathy, and a pyruvate oxidation defect (Mayr et al., 2011). [from OMIM]Description Tests Pyruvate dehydrogenase lipoic acid synthetase deficiency
- Glyoxylate metabolism and glycine degradation, organism-specific biosystem (from REACTOME)
- Lipoic acid metabolism, organism-specific biosystem (from KEGG)
- Lipoic acid metabolism, conserved biosystem (from KEGG)
- Metabolic pathways, organism-specific biosystem (from KEGG)
- Metabolism, organism-specific biosystem (from REACTOME)
- Metabolism of amino acids and derivatives, organism-specific biosystem (from REACTOME)
- lipoate biosynthesis and incorporation, organism-specific biosystem (from BIOCYC)
Etiketter:
Liponihapon syntaasin geeni LIAS (Kr. 4p14)
Liponihapon synteesi ihmisessä: Keggin synteesi
http://www.genome.jp/kegg-bin/show_pathway?map=map00785&show_description=show
Tämä näyttää selkeämmin vaikutetavissa olevalta järjestelmältä rikkiaineenvaihdunnan antioksidanteissa kuin tauriinijärjestelmä. Tauriinin funktioo sasmisessa tarvitaan se P-Hcy vähentäminen. Tauriinin alue on näkymättömämpi tai siis vaikeammin hahmotettavissa tai osoitettavissa kynän kärjellä kuin liponihapon, - Tauriinin vaikutusalue on soluvolyymissa ja ulkopuolellakin solun, mutta liponihapon tehtäväkohta on aivan energian saannin fundamentaalisessa kapeikossa. Liponihapon tarve lie vain aivan mikrogrammaluokkia. mutta sitä täytyy olla.
Verrattuna glutationiin liponihappo on sikäli enemmän saatavilla oleva antioksidanttinen aines, koska sitä voidaan "syödä" kehoon. Mutta pohdin vain jos sitä käyttää liikaa, mitä jos tämä entsymaattinen systeemi säätyy geenitasossa heikommaksi? Geeni on kromosomissa 4p14 ja takuulla konservoitunut.
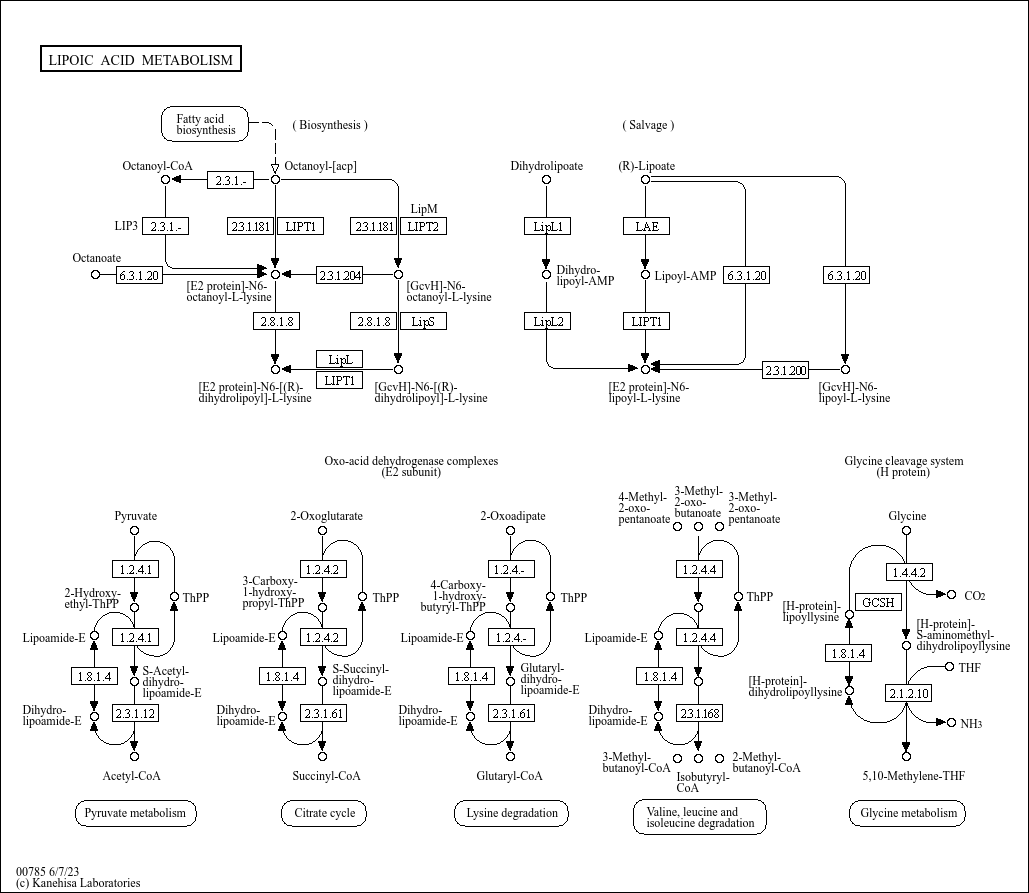
Tämä näyttää selkeämmin vaikutetavissa olevalta järjestelmältä rikkiaineenvaihdunnan antioksidanteissa kuin tauriinijärjestelmä. Tauriinin funktioo sasmisessa tarvitaan se P-Hcy vähentäminen. Tauriinin alue on näkymättömämpi tai siis vaikeammin hahmotettavissa tai osoitettavissa kynän kärjellä kuin liponihapon, - Tauriinin vaikutusalue on soluvolyymissa ja ulkopuolellakin solun, mutta liponihapon tehtäväkohta on aivan energian saannin fundamentaalisessa kapeikossa. Liponihapon tarve lie vain aivan mikrogrammaluokkia. mutta sitä täytyy olla.
Verrattuna glutationiin liponihappo on sikäli enemmän saatavilla oleva antioksidanttinen aines, koska sitä voidaan "syödä" kehoon. Mutta pohdin vain jos sitä käyttää liikaa, mitä jos tämä entsymaattinen systeemi säätyy geenitasossa heikommaksi? Geeni on kromosomissa 4p14 ja takuulla konservoitunut.

lördag 13 februari 2016
FXR ja antgiotensiinireseptorit
Items: 4
- Showing results for angiotensin receptors, fxr. Search instead for angiotensinreceptors, FXR (0)
1.
Lehman AM, Montford JR, Horita H, Ostriker AC, Weiser-Evans MC, Nemenoff RA, Furgeson SB.
Mol Pharmacol. 2014 Nov;86(5):570-9. doi: 10.1124/mol.114.092163. Epub 2014 Aug 28.
- PMID:
- 25169989
2.
Levi M, Wang X, Choudhury D.
Contrib Nephrol. 2011;170:209-16. doi: 10.1159/000325668. Epub 2011 Jun 9. Review.
Abstract In spite of excellent glucose and blood pressure control, including administration of angiotensin-converting enzyme inhibitors and/or angiotensin
II receptor blockers, diabetic nephropathy (DN) still develops and
progresses. The development of additional protective therapeutic
interventions is, therefore, a major priority. Nuclear hormone receptors
regulate carbohydrate metabolism, lipid metabolism, the immune
response, inflammation and development of fibrosis. The increasing
prevalence of DN has led to intense investigation of the role that
nuclear hormone receptors
may have in slowing or preventing the progression of renal disease.
Several nuclear receptor-activating ligands (agonists) have been shown
to have a renal protective effect in the context of DN. This review will
discuss the evidence regarding the beneficial effects of the activation
of the vitamin D receptor (VDR) and the farnesoid X receptor (FXR)
in preventing the progression of DN, and will describe how the
discovery and development of compounds that modulate the activity of VDR
and FXR may provide potential additional therapeutic approaches in the management of DN.
Copyright © 2011 S. Karger AG, Basel.
- PMID:
- 21659773
- [PubMed - indexed for MEDLINE]
- PMID:
- 21659773
3.
Levi M.
Biochim Biophys Acta. 2011 Aug;1812(8):1061-7. doi: 10.1016/j.bbadis.2011.04.003. Epub 2011 Apr 14. Review.
- PMID:
- 21511032
4.
Zhang Q, He F, Kuruba R, Gao X, Wilson A, Li J, Billiar TR, Pitt BR, Xie W, Li S.
Cardiovasc Res. 2008 Feb 1;77(3):560-9. Epub 2007 Nov 13.
Abstract AIMS:The farnesoid X receptor (FXR)
is a member of the nuclear receptor superfamily and plays an important
role in the pathogenesis of cardiovascular diseases via regulating the
metabolism and transport of cholesterol. We and others have recently
shown that FXR
is also expressed in the vasculature, including endothelial cells and
smooth muscle cells (SMC). However, the biological significance of FXR activation in SMC is still poorly understood. In this study, we examine the effect of FXR ligands on the angiotensin system in rat aortic SMC (RASMC), as angiotensin II (Ang II) signalling contributes to various types of vascular lesions by promoting cell growth of vascular SMC. METHODS AND RESULTS: Treatment of RASMC with a FXR
ligand showed no obvious effect on the expression of angiotensinogen,
Ang II type 1 receptor (AT1R) or type 4 receptor (AT4R) but led to a
significant increase in the expression of type 2 receptor (AT2R). FXR
ligand treatment also resulted in an inhibition of Ang II-mediated
extracellular signal-regulated kinase (ERK) activation and growth
proliferation. Promoter reporter gene and electrophoretic mobility-shift
assays suggest that FXR upregulates AT2R expression at a transcriptional level. Upregulation of AT2R appears to play a role in the FXR-mediated
inhibition of ERK activation via upregulation of Rous sarcoma oncogene
(Src) homology domain-containing tyrosine phosphatase 1 (SHP-1) because FXR-mediated upregulation of SHP-1 can be blocked by an AT2R antagonist and FXR-mediated ERK inactivation was significantly attenuated via treatment with either an AT2R antagonist or a SHP-1 inhibitor.
CONCLUSION: (Comment: hmmmmm)
FXR in SMC may serve as a novel molecular target for modulating Ang II signalling in the vasculature.- PMID:
- 18006431
- [PubMed - indexed for MEDLINE]
- PMID:
- 18006431
Tauriini ja ihmisen silmän verkkokalvo (Artikkeli vuodelta 2002)
Nutr Neurosci. 2002 Apr;5(2):75-90.
Taurine: evidence of physiological function in the retina. Militante JD1, Lombardini JB.
Abstract
Taurine
is a free amino acid found in high millimolar concentrations in
mammalian tissue and is particularly abundant in the retina. Mammals
synthesize taurine endogenously with varying abilities, with some species more dependent on dietary sources of taurine than others. Human children appear to be more dependent on dietary taurine than adults. Specifically, it has been established that visual dysfunction in both human and animal subjects results from taurine deficiency. Moreover, the deficiency is reversed with simple nutritional supplementation with taurine. The data suggest that taurine is an important neurochemical factor in the visual system. However, the exact function or functions of taurine in the retina are still unresolved despite continuing scientific study. Nevertheless, the importance of taurine in the retina is implied in the following experimental findings: (1) Taurine exhibits significant effects on biochemical systems in vitro. (2) The distribution of taurine is tightly regulated in the different retinal cell types through the development of the retina. (3) Taurine depletion results in significant retinal lesions. (4) Taurine release and uptake has been found to employ distinct regulatory mechanisms in the retina.
- PMID:
- 12000086
- [PubMed - indexed for MEDLINE]
Etiketter:
Tauriini ja silmä,
verkkokalvo retina
Tauriini , kissat ja koirat . Tauriinin tarve dieetissä
http://www.ncbi.nlm.nih.gov/pubmed/?term=Requirement+of+taurine+in+diet
1.
Kanakubo K, Fascetti AJ, Larsen JA.
J Am Vet Med Assoc. 2015 Aug 15;247(4):385-92. doi: 10.2460/javma.247.4.385.
- PMID:
- 26225610
2.
Espe M, Andersen SM, Holen E, Rønnestad I, Veiseth-Kent E, Zerrahn JE, Aksnes A.
Br J Nutr. 2014 Oct 28;112(8):1274-85. doi: 10.1017/S0007114514002062. Epub 2014 Sep 8.
- PMID:
- 25196630
3.
de Godoy MR, Beloshapka AN, Carter RA, Fascetti AJ, Yu Z, McIntosh BJ, Swanson KS, Buff PR.
J Nutr Sci. 2014 Sep 30;3:e33. doi: 10.1017/jns.2014.46. eCollection 2014.
- PMID:
- 26101602
4.
de Godoy MR, Kerr KR, Fahey GC Jr.
Nutrients. 2013 Aug 6;5(8):3099-117. doi: 10.3390/nu5083099. Review.
- PMID:
- 23925042
5.
Verbrugghe A, Bakovic M.
Nutrients. 2013 Jul 19;5(7):2811-35. doi: 10.3390/nu5072811. Review.
- PMID:
- 23877091
6.
Ko KS, Backus RC, Berg JR, Lame MW, Rogers QR.
J Nutr. 2007 May;137(5):1171-5.
- PMID:
- 17449577
7.
Bouckenooghe T, Remacle C, Reusens B.
Curr Opin Clin Nutr Metab Care. 2006 Nov;9(6):728-33. Review.
- PMID:
- 17053427
8.
Martín-Venegas R, Geraert PA, Ferrer R.
Poult Sci. 2006 Nov;85(11):1932-8.
- PMID:
- 17032826
9.
Backus RC, Ko KS, Fascetti AJ, Kittleson MD, Macdonald KA, Maggs DJ, Berg JR, Rogers QR.
J Nutr. 2006 Oct;136(10):2525-33.
- PMID:
- 16988121
10.
Zhang Y, Dabrowski K, Hliwa P, Gomulka P.
Amino Acids. 2006 Sep;31(2):165-72. Epub 2006 May 29.
- PMID:
- 16733614
11.
Morris JG.
Nutr Res Rev. 2002 Jun;15(1):153-68. doi: 10.1079/NRR200238.
- PMID:
- 19087402
12.
Wu G, Davis PK, Flynn NE, Knabe DA, Davidson JT.
J Nutr. 1997 Dec;127(12):2342-9.
- PMID:
- 9405584
13.
Kim SW, Rogers QR, Morris JG.
J Nutr. 1996 Feb;126(2):509-15.
- PMID:
- 8632225
14.
Kim SW, Morris JG, Rogers QR.
J Nutr. 1995 Nov;125(11):2831-7.
- PMID:
- 7472663
15.
Backus RC, Rogers QR, Morris JG.
J Nutr. 1994 Dec;124(12 Suppl):2540S-2545S.
- PMID:
- 7996233
16.
Dueland S, Drisko J, Graf L, Machleder D, Lusis AJ, Davis RA.
J Lipid Res. 1993 Jun;34(6):923-31.
- PMID:
- 8354958
17.
Uthus EO.
Environ Geochem Health. 1992 Jun;14(2):55-8. doi: 10.1007/BF01783629.
- PMID:
- 24197927
18.
Cowey CB, Cho CY, Sivak JG, Weerheim JA, Stuart DD.
J Nutr. 1992 May;122(5):1154-63.
- PMID:
- 1564569
19.
Cantafora A, Blotta I, Rossi SS, Hofmann AF, Sturman JA.
J Nutr. 1991 Oct;121(10):1522-8.
- PMID:
- 1765815
20.
Earle KE, Smith PM.
Br J Nutr. 1991 Sep;66(2):227-35.
- PMID:
- 1760443
Etiketter:
kissat ja koirat,
Tauriinin tarve dieetissä
Prenumerera på:
Kommentarer (Atom)