Myös Hcy:n alavirta kataboliassa on syöpää aiheuttavia aineenvaihduntalinjoja, mutta jos ne voi oikaista siten että saadaan syntymään tarppeksi runsaasti tärkeää soluvolyymitekijää tauriinia toisaalta ja toisaalta tavallista detoksikoivaa sulfaattia ja rheologiassa tarvittavaa sulfaattiverkostoa ja aktiivia sulfaattia, niin tie on "auki".
Tässä ovat avuksi: B12- ja folaatin saannin tarkistus, siten että jokaisella Hcy pysyy aisoissa, sen pitoisuus ei saa noust asiis yhtään siitä, mikä nykyisin oletetaan normaaliksi. Pitää pohtia pitäisikö sitä näkyä ollenkaan, vai pitäisikö sen heti kadota normaaliteihinsä ylöspäin (SAM ) tai alaspäin ( tauriini, sulfaatti) tai peptidisynteesi. Ei kai mitään Hcy allasta tarvita??
Tässä siis on Co ja sen entsyymit mukana.
Ongelmakohta on esim molybdeeninaineenvaihdunnassa (Mo) BH4-BH2 pteridiinirakenteen alueen "vitamiini", jota siis pitäisi itsestään muodostua ettei se olisikaan vitamiini. Mo on extra molekyyli mitä vaikeimmassa rexoxkohdassa, ehkä kromillekin löytyy siinä funktio.
Sieltä häiriöstä tulee melanoman siemenet - puhumattakaan kansantaudeista AD ja PD.
Superoksidianionin ympäristön käsittelyyn pitää lisätä myös kromi Cr . Ei vain Cu, Zn ja Mn.
Olen kertaamassa nyt essentiellejä mineraaleja, joten jatkan tätä päivitysten jälkeen.
Aivoalueen essentiellien mineraalien kartoittaminen synkronisoivaksi kartaksi redoxin suhteen on vielä kesken.. pohdin asiaa. Kriittisten aminohappojen Phe, Tyr, Trp) kofaktorien synkronisointi.
-- Päivitän ensin raudan. ennenkuin palaan tähän. Otan melanomasta esiin hakusanan Hcy, melanoma, 15 vastausta. Tässä on ylävirta-asiaa ensin.
Search results
Items: 15
- PMID:
- 19200761
- PMID:
- 18084618
- PMID:
- 15826948
- PMID:
- 15153315
- PMID:
- 9627769
- PMID:
- 7611281
- PMID:
- 7757071
- PMID:
- 8495409
- PMID:
- 1748723
- PMID:
- 2298245
- PMID:
- 2592434
- PMID:
- 2917339
- PMID:
- 3401842
- PMID:
- 3359424
- PMID:
- 7388782
Alavirta-asiassa tulee mm pteridiinitein synteesialue ( BH4- BH2 ) joka kuuluu redixkartalle siellä missä on GTP, Phe, Tyr, Trpp, superoksidin ja NO:n kehittyminen. missä pitäisi cys- sulfaatti tein toimia.
http://www.ncbi.nlm.nih.gov/pmc/articles/PMC1890551/
Tässä läheessä on pteridiinin synteesikartta ja siinä manitaan esim isoxanthopterin molekyyli, joka syöpäpotilailla on poikkeava, ja ilmentää että silloin kartta ei toimi., eritys alentunut. Siis voi olla että BH4- BH2 funktio "puuttuu", on vajaa, vitamiinitasoksi mennyttä. jo alkusynteesistä. Normaalisti sitä pitäisi muodostua aivoissa hienosti GTP.stä käsin. Tässä muuten voi mainita että Cr(III)GTP on myös mahdollinen molekyyli. Cr(III) O2- on myös mahdollinen transientti molekyyli.
Että BH4- BH2 sykli voi olla vajeinen , voi johtua siitä että se sykkii aivoissa circadisesta rytmistä ja pimeähormonista nor-melatoniinivaiheesta käsin BH4- muodostavat entsyymit vaimenevat.
Nor-melatoniini, elin N-Ac-serotoniini estää entsyymejä jotka muodostavat BH4 biopteriinia.
( Mutta sanotaan että käpyisäke kalkkeuttuu ihmisillä, liekö se niin toimivakaan. Mutta onhan sitaä muita soluja jotka vastavat valon ja pimeän vaihteluun, esim koko iho). Normelatoniini tarvitse metylaation tullakseen melatoniiniksi. joka on pimeähormoni.
Valmis BH4 vaimentaa N-Ac-serotoniinisynteesiä.Siihen varmaan avustaa aurinko- kirjan kartalla.
Aamulla melatoniinisynteesi vähenee ja samalla arousel- valmius (ACTH jne) lisääntyy. Pohdittavaksi tämä.


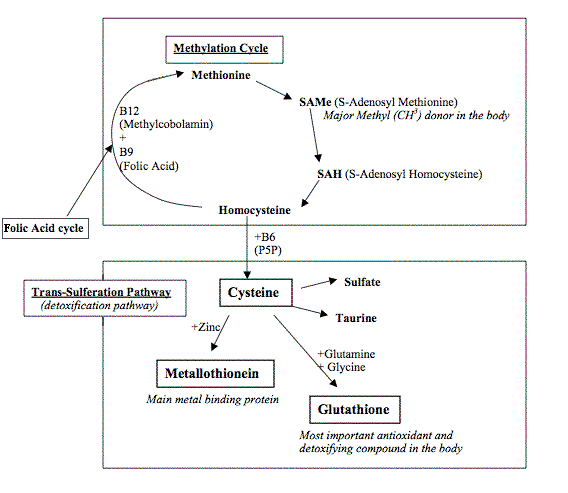
 Kuten kartasta huomaa, täydellisen kartan kärhenä on tauriinin normaali muodostus.Tauriini on tavallaan merkitsijä rikkiaineenvaihdunnasta.
Kuten kartasta huomaa, täydellisen kartan kärhenä on tauriinin normaali muodostus.Tauriini on tavallaan merkitsijä rikkiaineenvaihdunnasta.