- Official Symbol
- GPHNprovided by HGNC
- Official Full Name
- gephyrin provided by HGNC
- Primary source
- HGNC:HGNC:15465
- See related
- Ensembl:ENSG00000171723; HPRD:04893; MIM:603930; Vega:OTTHUMG00000029785
- Gene type
- protein coding
- RefSeq status
- REVIEWED
- Organism
- Homo sapiens
- Lineage
- Eukaryota; Metazoa; Chordata; Craniata; Vertebrata; Euteleostomi; Mammalia; Eutheria; Euarchontoglires; Primates; Haplorrhini; Catarrhini; Hominidae; Homo
- Also known as
- GPH; GEPH; HKPX1; GPHRYN; MOCODC
- Yhteenveto:
- Tämä geeni koodaa hermosolussa kokoontuvaa proteiinia, joka ankkuroi inhibitoristen hermonvälittäjäaineitten reseptoreita postsynaptiseen sytoskeletoniin sitoutumalla suurella affiniteetilla reseptorialayksikön domeeniin ja tubuliinidimeereihin.
- Muussa kuin hermokudoksessa tätä koodautuvaa proteiinia myös vaaditaan molybdeenikofaktorin biosynteesiin.
- Tämän geenin mutaatiot lienevät assosioituneet hyperplexian neurologiseen tilaan ja myös johtavat molybdeenikofaktorin vajeeseen.
- On kuvattu lukuisia pleissivariantteja, joista koodautuu erilaisia isoformeja kuitenkaan kaikkien varianttien luonnollista täyspitkää transkriptia ei vielä tunneta.
- Summary
- This gene encodes a neuronal assembly protein that anchors
inhibitory neurotransmitter receptors to the postsynaptic cytoskeleton
via high affinity binding to a receptor subunit domain and tubulin
dimers. In nonneuronal tissues, the encoded protein is also required for
molybdenum cofactor biosynthesis. Mutations in this gene may be
associated with the neurological condition hyperplexia and also lead to
molybdenum cofactor deficiency. Numerous alternatively spliced
transcript variants encoding different isoforms have been described;
however, the full-length nature of all transcript variants is not
currently known. [provided by RefSeq, Jul 2008]
Yleissilmäys peptidiin:
ORIGIN 1 mategmiltn hdhqirvgvl tvsdscfrnl aedrsginlk dlvqdpsllg gtisaykivp 61 deieeiketl idwcdekeln lilttggtgf aprdvtpeat keviereapg malamlmgsl 121 nvtplgmlsr pvcgirgktl iinlpgskkg sqecfqfilp alphaidllr daivkvkevh 181 deledlpspp pplsppptts phkqtedkgv qceeeeeekk dsgvasteds ssshitaaai 241 aakkhpfyts pavvmahgeq pipglinysh hstderipds iisrgvqvlp rdtaslsttp 301 sespraqats rlstascptp kvqsrcsske nilrashsav ditkvarrhr mspfpltsmd 361 kafitvlemt pvlgteiiny rdgmgrvlaq dvyakdnlpp fpasvkdgya vraadgpgdr 421 fiigesqage qptqtvmpgq vmrvttgapi pcgadavvqv edteliresd dgteelevri 481 lvqarpgqdi rpighdikrg ecvlakgthm gpseigllat vgvtevevnk fpvvavmstg 541 nellnpeddl lpgkirdsnr stllatiqeh gyptinlgiv gdnpddllna lnegisradv 601 iitsggvsmg ekdylkqvld idlhaqihfg rvfmkpglpt tfatldidgv rkiifalpgn 661 pvsavvtcnl fvvpalrkmq gildprptii karlscdvkl dprpeyhrci ltwhhqeplp 721 waqstgnqms srlmsmrsan gllmlppkte qyvelhkgev vdvmvigrl
tisdag 28 oktober 2014
GPHN, Gephyrin gene, kromosomi 14q23.3. ( Artikkeli vuodelta 2008)
Gly reseptoreitten sijainnista synapsissa. Gefyriinin merkitys.
Kuva:osoittaa yleensä kuvien puuttuvassa kohdassa lisärakenteen gephyrin, Katson sitä välillä.
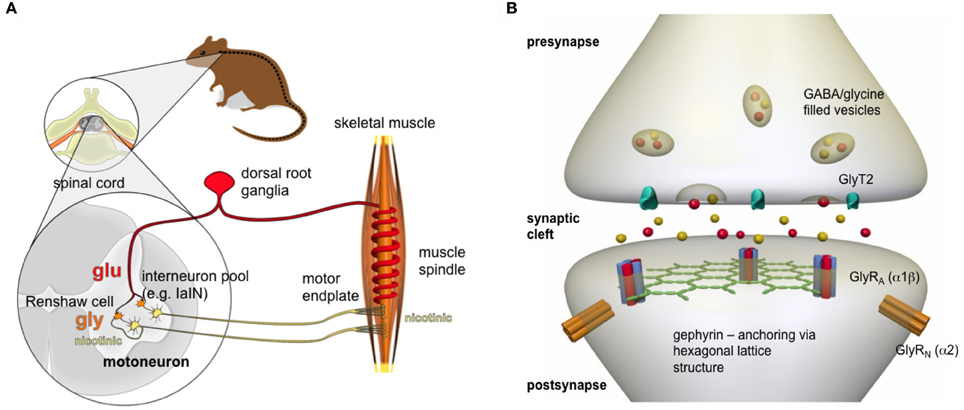
http://www.nature.com/nrn/journal/v15/n3/full/nrn3670.html
The neurotransmitters GABA and glycine mediate fast synaptic
inhibition by activating ligand-gated chloride channels — namely, type A
GABA (GABAA) and glycine receptors. Both types of receptors
are anchored postsynaptically by gephyrin, which self-assembles into a
scaffold and interacts with the cytoskeleton. Current research indicates
that postsynaptic gephyrin clusters are dynamic assemblies that are
held together and regulated by multiple protein–protein interactions.
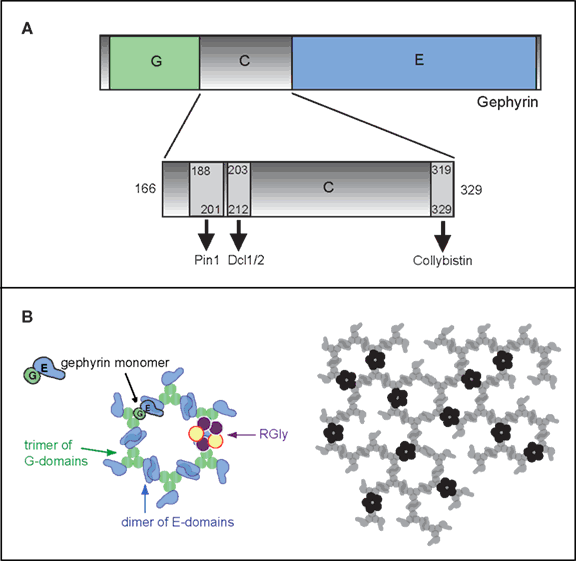

http://www.nature.com/nrn/journal/v15/n3/full/nrn3670.html
Nature Reviews Neuroscience |
Review
Gephyrin: a master regulator of neuronal function?
- Published online
- Lisäksi gefyriinin posttranslationaalinen modifikaatio säätelee GABA-ergisten synapsien muodostumista ja plastisuutta muuntamalla postsynaptisten tukirakenteitten ryvästymisominaisuuksia ja siten reseptoreitten ja muitten molekyylien saavutettavuutta ja funktiota
- Tässä artikkelissaan tutkijat pohtivat gefyyriinitukiverkoston muodostumista ja säätymistä , sen roolia GABAergisessä ja glysinergisessä synaptisessa funktiossa ja tiedon soveltamista aivoperäisten häiriöitten patofysiologiaan, missä häiriön takana on epänormaali inhibitorinen neurotransmissio.

Etiketter:
GABA A,
Gefyriini,
GlyR,
isynaptinen inhibitio,
Kloridikanava
Tauriini on fysiologinen gliotransmittoriaine
J Neurosci. 2012 Sep 5;32(36):12518-27. doi: 10.1523/JNEUROSCI.1380-12.2012.
Taurine release by astrocytes modulates osmosensitive glycine receptor tone and excitability in the adult supraoptic nucleus (S.O.N.) .
Abstract
Cells can release the free amino acid taurine through volume-regulated anion channels (VRACs), and
it has been hypothesized that taurine released from glial cells is capable of inhibiting action potential (AP) firing by activating neuronal glycine receptors (GlyRs) (Hussy et al., 1997).
Although an inhibitory GlyR tone is widely observed in the brain, it remains unknown whether this specifically reflects gliotransmission because most neurons also express VRACs and other endogenous molecules can activate GlyRs.
We found that VRACs are absent in neurons of the rat supraoptic nucleus (SON),
suggesting that glial cells are the exclusive source of taurine in this nucleus.
Application of strychnine to rat hypothalamic explants caused a depolarization of SON neurons associated with a decrease of chloride conductance and could excite these cells in the absence of fast synaptic transmission.
This inhibitory GlyR tone was eliminated by pharmacological blockade of VRACs, by cellular taurine depletion, by metabolic inactivation of glia with fluorocitrate, and after retraction of astrocytic processes that intercalate neuronal somata and dendrites.
Finally, GlyR tone varied inversely with extracellular fluid tonicity to mediate the osmotic control of AP firing by SON neurons. These findings establish taurine as a physiological gliotransmitter and show that gliotransmission is a spatially constrained process that can be modulated by the morphological rearrangement of astrocytes.
it has been hypothesized that taurine released from glial cells is capable of inhibiting action potential (AP) firing by activating neuronal glycine receptors (GlyRs) (Hussy et al., 1997).
Although an inhibitory GlyR tone is widely observed in the brain, it remains unknown whether this specifically reflects gliotransmission because most neurons also express VRACs and other endogenous molecules can activate GlyRs.
We found that VRACs are absent in neurons of the rat supraoptic nucleus (SON),
suggesting that glial cells are the exclusive source of taurine in this nucleus.
Application of strychnine to rat hypothalamic explants caused a depolarization of SON neurons associated with a decrease of chloride conductance and could excite these cells in the absence of fast synaptic transmission.
This inhibitory GlyR tone was eliminated by pharmacological blockade of VRACs, by cellular taurine depletion, by metabolic inactivation of glia with fluorocitrate, and after retraction of astrocytic processes that intercalate neuronal somata and dendrites.
Finally, GlyR tone varied inversely with extracellular fluid tonicity to mediate the osmotic control of AP firing by SON neurons. These findings establish taurine as a physiological gliotransmitter and show that gliotransmission is a spatially constrained process that can be modulated by the morphological rearrangement of astrocytes.
- PMID:
- 22956842
- [PubMed - indexed for MEDLINE]
Etiketter:
Astrosyytti,
gliotransmittor,
GlyR,
volyme regulated anion channel,
VRAC
MRI, aivoiskemia ja aminohapot
Magn Reson Med. 2014 Jan;71(1):118-32. doi: 10.1002/mrm.24639. Epub 2013 Feb 11.
Sensitivity and source of amine-proton exchange and amide-proton transfer magnetic resonance imaging in cerebral ischemia.
Abstract
PURPOSE:
Amide-proton transfer (APT) and amine-water proton exchange (APEX) MRI can be viable to map pH-decreasing ischemic regions. However, their exact contributions are unclear.METHODS:
We measured APEX- and APT-weighted magnetization transfer ratio asymmetry (denoted as APEXw and APTw), apparent diffusion coefficient, T2 , and T1 images and localized proton spectra in rats with permanent middle cerebral artery occlusion at 9.4 T.Phantoms and theoretical studies were also performed.
RESULTS:
Within 1-h postocclusion, APEXw and APTw maps showed hyperintensity (3.1% of M0 ) and hypointensity (-1.8%), respectively, in regions with decreased apparent diffusion coefficient.Ischemia increased lactate (LA) and gamma aminobutyric acid (GABA) concentrations, but decreased glutamate and taurine concentrations.
Over time, the APEXw contrast decreased with glutamate, taurine, and creatine, whereas the APTw contrast and lactate level were similar.
Phantom and theoretical studies suggest that the source of APEXw signal is mainly from proteins at normal pH, whereas at decreased pH, gamma aminobutyric acid (GABA) and glutamate contributions increase, inducing the positive APEXw contrast in ischemic regions.
The APTw contrast is sensitive to lactate (LA) concentration and pH, but contaminated from contributions of the faster APEX processes.
CONCLUSION:
Positive APEXw contrast is more sensitive to ischemia than negative APTw contrast. They may provide complementary tissue metabolic information.KEYWORDS:
MR spectroscopy; amide; amine; apparent diffusion coefficient; cerebral ischemia; chemical exchange saturation transfer; spin locking; stroke- PMID:
- 23401310
- [PubMed - indexed for MEDLINE]
- PMCID:
- PMC3655131
- [Available on 2015/1/1]
Tauriini, Asetylkoliiniesteraasi(AChE) ja koliini-asetyylitransferaasi (ChAT)
J Biomed Sci. 2014 May 24;21:51. doi: 10.1186/1423-0127-21-51.
Taurine improves the spatial learning and memory ability impaired by sub-chronic manganese exposure.
Tiivistelmä ,Abstract
TAUSTA: Liiallinen mangaanialtistus (Mn) aiheuttaa kognitiivisiä vajeita. Moni näyttö osoittaa, että tauriini voi parantaa kognitiivista heikentymistä, mitä monesta neurotoksiinista johtuu. Mutta vielä vaatii lisäselvittämistä, mikä tauriinin rooli on mangaanin (Mn) aiheuttamissa oppimisen ja muistin vaurioissa Tässä tutkimuksesa koetetaan osoittaa tauriinin edut oppimis-ja muistihäiriön parantamisessa mangaanialtistetussa koe-eläimessä.
BACKGROUND: Excessive manganese exposure induced cognitive deficit. Several lines of evidence have demonstrated that taurine improves cognitive impairment induced by numerous neurotoxins. However, the role of taurine on manganese-induced damages in learning and memory is still elusive. This goal of this study was to investigate the beneficial effect of taurine on learning and memory capacity impairment by manganese exposure in an animal model.
TULOKSET : Koe-eläimiä testattiin Morris Water Maize testillä mangaanialtistuksen jälkeen ja sekä samanaikasen tauriinin annon + mangaanialtistuksen jälkeen. Mangaanin veripitoisuus ei kuitenkaan vaikuttunut tauriinin annosta. Mangaanialtistus johti merkitsevään asetylkolinesteraasiaktiivisuuden (AChE) lisääntymään ja koliiniasetyltransferaasin (ChAT) aktiivisuuden vähenemään, mikä osittain palautui tauriinilisästä. Lisäksi tutkijat tunnistivat proteomianalyysissä 2D geelielektroforeesilla ja massa spektrometrillä 9 hippokampi proteiinia, jotka ilmenivät eri tavalla niillä koe-eläimiltä, joita oli käsitelty mangaanilla ja niillä jotka saivat lisäksi tauriinia. Niistä proteiineista suurin osa toimii energia-aineenvaihdunnassa, oksidatiivisessa stressisä, tulehduksessa ja neuronisynapsissa.
RESULTS:The escape latency in the Morris Water Maze test was significantly longer in the rats injected with manganese than that in the rats received both taurine and manganese. Similarly, the probe trial showed that the annulus crossings were significantly greater in the taurine plus manganese treated rats than those in the manganese-treated rats. However, the blood level of manganese was not altered by the taurine treatment. Interestingly, the exposure of manganese led to a significant increase in the acetylcholinesterase activity and an evidently decrease in the choline acetyltransferase activity, which were partially restored by the addition of taurine. Additionally, we identified 9 differentially expressed proteins between the rat hippocampus treated by manganese and the control or the manganese plus taurine in the proteomic analysis using the 2-dimensional gel electrophoresis followed by the tandem mass spectrometry (MS/MS). Most of these proteins play a role in energy metabolism, oxidative stress, inflammation, and neuron synapse.
Yhteenveto: Tauriini palauttaa AChE ja ChAT entsyymiaktiivisuuksia, jotka ovat kriittisiä asetylkoliinin säätelylle. Tutkijat identifioivat seitsemän spesifisesti mangaanin indusoimaa proteiinia ja kaksi tauriinin indusoimaa proteiinia hippokampista. Tulokset tukevat sitä käsitystä, että tauriini kohentaa oppimis- ja muistikykyä niillä, joilla syynä on ollut altistuminen liika mangaanille.
CONCLUSIONS: In summary, taurine restores the activity of AChE and ChAT, which are critical for the regulation of acetylcholine. We have identified seven differentially expressed proteins specifically induced by manganese and two proteins induced by taurine from the rat hippocampus. Our results support that taurine improves the impaired learning and memory ability caused by excessive exposure of manganese.
Kuva kahden hermosolun, neuronin, välisestä synapsista, jossa välittäjäaineena toimii AK, asetyylikoliini ( ACh) , Ak neuronijärjestelmä on kuin "resiina joka tarkistaa raiteet", siis pitää hermojärjestelmää funktiokykyisenä verkostona, eräänlainen clearing funktio, varsinkin kun ihminen toimii jotakin tahdonalaista käytännössä.
Gene ACHE, Acheylcholinesterase, ISBT011 Blood group Cartwright, YT (7q22.1)
Plasman vapaat aminohapot, syöpäkudoksen ja syövänvierikudosten vapaat aminohapot ( keuhkosyöpä)
Keuhkosyöpäpotilaiden plasman ja kudoksettoman alueen aminohappokirjot j pitoisuuksien vertailu
Asia Pac J Clin Nutr. 2014;23(3):429-36. doi: 10.6133/apjcn.2014.23.3.13.
Plasma and tissue free amino acid profiles and their concentration correlation in patients with lung cancer.
Tiivistelmä, Abstract in English, Chinese
- Muuntelut plasman vapaissa aminohapoissa (PFAA) ovat syöpäpotilailla proteiiniaineenvaihdunnan poikkeavuuksien olennainen piirre. Silti on vain vähän tietoa syöpä kudoksen vapaiden aminohappojen (TFAA) kirjosta ja kirjomalleista ja korrelaatioista plasman vapaisiin aminohappoihin.(PFAA)..
- Tutkijat halusivat arvioida plasman vapaiden aminohappojen (PFAA) ja syöpäkudoksen vapaiden aminohappojen (TFAA) vaihteluita keuhkosyöpäpotilailla- myös heidän aminohappomallinsa ja aminohappokorrelaatiot.
- Tässä tarkoituksesa he analysoivat keuhkosyöpäkudoksen (n= 27) ja molemmista keuhkoista syövän viereisten ( paracarcinomous) kudosten (n= 27) ja plasman ( (n= 27) vapaitten aminohappojen pitoisuudet automaattisella aminohappoanalysaattorilla.
Variation of plasma free amino acids (PFAAs) is an essential feature of protein metabolic abnormalities in cancer patients. But there still little data about the cancer
tissue free amino acid (TFAAs) profiles, including their patterns and
correlations with PFAAs. To evaluate the variation in PFAAs and cancer TFAAs in patients with lung cancer, including their patterns and correlations, we investigated the concentrations of free amino acids in lung cancer
tissues (n=27), paired lung paracarcinomous tissues (n=27) and plasma
(n=27) using an automatic amino acid analyzer after pre-treatment.
- Plasman aminohappokirjossa (PFAA) oli merkitsevästi alentunut viisi aminohappoa : tryptofaani(W), glysiini (G), sitrulliini, ornitiini ja proliini (P) , kun taas fenylalaniini (F) oli huomattavasti lisääntynyt verrattaessa kontrollihenkilöihin.
- Kudosten aminohappokirjossa (TFAA) oli kolme aminohappoa lisääntynyt: tauriini, glutamiini(Q) ja glysiini(G), kun taas kaksi aminohappoa, lysiini (K) ja ornitiini, olivat merkitsevästi vähentyneet keuhkosyöpäkudoksessa verrattuna parakarsinomaattisiin kudoksiin.
- Aminohappokirjomallit osoittivat molemmissa kirjoissa (PFAA ja TFAA ) samanlaista trendiä, suuntausta, mutta muutosten prosentuaalisuudet erosivat.
- Lisäksi plasman viiden vapaan aminohapon, lysiini (K), fenylalaniini (F), treoniini (T), seriini (S) , alaniini( A), pitoisuudet korreloivat keuhkokarsinoomakudoksen vapaitten aminohappojen ( TFAA) -pitoisuuksiin, mutta mikään plasman vapaa aminohappo ei korreloinut keuhkon parakarsinoomakudoksen vapaisiin aminohappoihin.
- Täten plasman vapaitten aminohappojen (PFAA) kirjot saattavat heijastaa syöpäkudoksien tilaa, mikä saattaa antaa lisäinformaatiota metabolisista statuksesta ja ennusteesta keuhkosyöpäpotilailla.
- PMID:
- 25164454
- [PubMed - indexed for MEDLINE]
Prenumerera på:
Inlägg (Atom)
